Glucagon er et peptidhormon, der produceres af alfa-celler i bugspytkirtlen. Glucagon øger koncentrationen af glukose og fedtsyrer i blodbanen og betragtes som det vigtigste katabolske hormon i kroppen. Glucagon bruges også som medicin til behandling af en række sundhedsmæssige forhold. Effekten af glukagon er modsat den af insulin, som sænker ekstracellulær glukose. Glucagon er produceret af proglucagon, kodet af GCG-genet.
Bugspytkirtlen frigiver glukagon, når mængden af glukose i blodbanen er for lav. Glucagon får leveren til at engagere sig i glykogenolyse: omdannelse af lagret glykogen til glukose, som frigives i blodbanen. Høje blodglukoseniveauer stimulerer derimod frigivelsen af insulin. Insulin tillader, at glukose optages og bruges af insulinafhængige væv. Således er glucagon og insulin en del af et feedback-system, der holder blodsukkerniveauet stabilt. Glucagon øger energiforbruget og hæves under stressforhold. Glucagon hører til secretin-familien af hormoner.
Glukagon funktion
Glucagon hæver generelt koncentrationen af glukose i blodet ved at fremme gluconeogenese og glykogenolyse. Glucagon nedsætter også fedtsyresyntese i fedtvæv og lever. Glucagon fremmer lipolyse i disse væv, hvilket får dem til at frigive fedtsyrer i omløb, hvor de kan kataboliseres for at generere energi i væv, såsom skeletmuskel, når det er nødvendigt.
Glucose opbevares i leveren i form af polysaccharidglycogenet, som er en glucan (en polymer, der består af glucosemolekyler). Leverceller (hepatocytter) har glucagonreceptorer. Når glucagon binder til glucagonreceptorerne, omdanner levercellerne glykogenet til individuelle glukosemolekyler og frigiver dem i blodbanen i en proces kendt som glykogenolyse. Når glukoselagring bliver udtømt, tilskynder glucagon derefter leveren og nyrerne til at syntetisere yderligere glukose ved gluconeogenese. Glucagon slukker glykolyse i leveren, hvilket får glykolytiske mellemprodukter til at blive skubbet til gluconeogenese.
Glucagon regulerer også hastigheden af glukoseproduktion gennem lipolyse. Glucagon inducerer lipolyse hos mennesker under insulinundertrykkelsesforhold (såsom diabetes mellitus type 1).
Glukagonproduktion ser ud til at være afhængig af centralnervesystemet gennem veje, der endnu ikke er defineret. Hos hvirvelløse dyr er det rapporteret, at fjernelse af øjne påvirker glucagonproduktionen. At udskære øjenstængen hos unge krebs producerer glukagon-induceret hyperglykæmi.
Virkningsmekanisme for glukagon
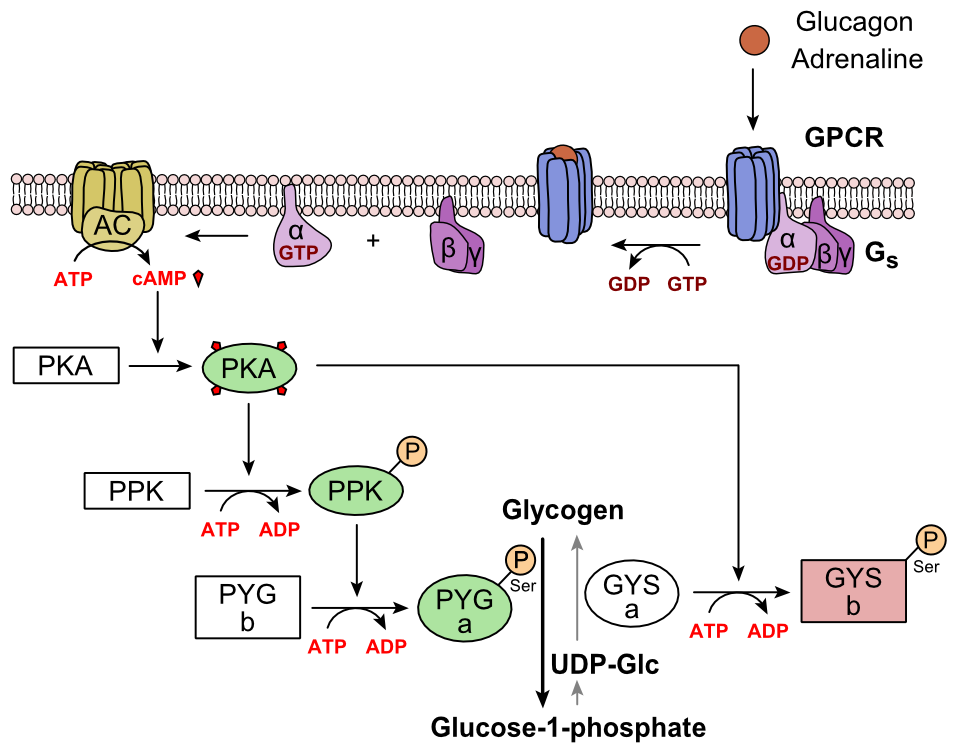
Glucagon binder til glucagonreceptoren, en G-proteinkoblet receptor, der er placeret i cellens plasmamembran. Konformationsændringen i receptoren aktiverer G-proteiner, et heterotrimert protein med α-, β- og y-underenheder. Når G-proteinet interagerer med receptoren, gennemgår det en konformationsændring, der resulterer i udskiftning af BNP-molekylet, der var bundet til α-underenheden med et GTP-molekyle. Denne substitution resulterer i frigivelse af α-underenheden fra β- og y-underenhederne. Alfa-underenheden aktiverer specifikt det næste enzym i kaskaden, adenylatcyclase.
Adenylatcyclase fremstiller cyklisk adenosinmonophosphat (cyklisk AMP eller cAMP), som aktiverer proteinkinase A (cAMP-afhængig proteinkinase). Dette enzym aktiverer igen phosphorylase-kinase, som derefter phosphorylerer glycogenphosphorylase b (PYG b) og omdanner den til den aktive form kaldet phosphorylase a (PYG a). Phosphorylase a er det enzym, der er ansvarlig for frigivelsen af glucose 1-phosphat fra glykogenpolymerer.
Et eksempel på vejen ville være, når glucagon binder til et transmembranprotein. De transmembrane proteiner interagerer med Gp3. G2 adskiller sig fra Gp3 og interagerer med transmembranproteinet adenylylcyclase. Adenylylcyclase katalyserer omdannelsen af ATP til cAMP. cAMP binder til proteinkinase A, og den komplekse phosphorylerer phosphorylase-kinase. Phosphoryleret phosphorylase kinase phosphorylerer phosphorylase. Phosphoryleret phosphorylase klipper glukosenheder fra glykogen som glucose 1-phosphat.
Derudover justeres den koordinerede kontrol af glykolyse og glukoneogenese i leveren ved fosforyleringstilstanden af enzymerne, der katalyserer dannelsen af en potent aktivator af glykolyse kaldet fructose 2,6-bisphosphat. Enzymproteinkinase A (PKA), som blev stimuleret af kaskaden initieret af glucagon, phosphorylerer også en enkelt serinrest fra den bifunktionelle polypeptidkæde indeholdende både enzymerne fructose 2,6-bisphosphatase og phosphofructokinase-2. Denne kovalente phosphorylering initieret af glucagon aktiverer førstnævnte og inhiberer sidstnævnte. Dette regulerer reaktionskatalysatoren af fructose 2,6-bisphosphat (en potent aktivator af phosphofructokinase-1, det enzym, der er det primære regulatoriske trin i glykolyse) ved at bremse hastigheden for dets dannelse og derved hæmme strømmen af glykolysevejen og tillade glukoneogenese at dominere. Denne proces er reversibel i fravær af glukagon (og dermed tilstedeværelsen af insulin).
Glukagonstimulering af PKA inaktiverer også det glykolytiske enzym pyruvatkinase i hepatocytter.
Fysiologi
Glucagon produktion
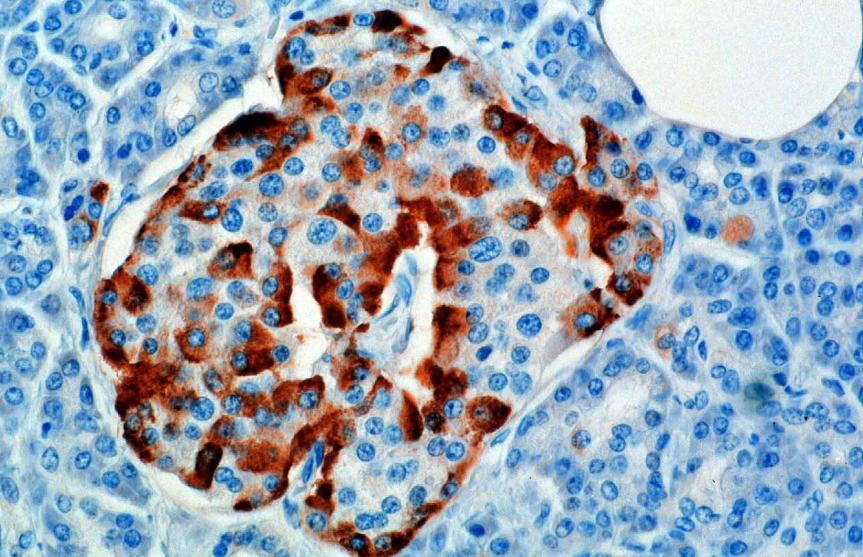
Hormonet syntetiseres og udskilles fra alfa-celler (α-celler) i Langerhans-øerne, som er placeret i den endokrine del af bugspytkirtlen. Produktion, som ellers er fritløbende, undertrykkes / reguleres af amylin, et peptidhormon co-udskilt med insulin fra β-cellerne i bugspytkirtlen. Efterhånden som plasmaglucoseniveauer aftager, lindrer den efterfølgende reduktion i amylinsekretion dets undertrykkelse af a-cellerne, hvilket muliggør glukagon-sekretion.
Hos gnavere er alfacellerne placeret i den ydre kant af holmen. Menneskelig holmstruktur er meget mindre adskilt, og alfa-celler fordeles gennem øen i nærheden af beta-celler. Glucagon produceres også af alfaceller i maven.
Nyere forskning har vist, at glucagonproduktion også kan finde sted uden for bugspytkirtlen, hvor tarmen er det mest sandsynlige sted for ekstrapancreatisk glucagon-syntese.
Glucagon regulering
Sekretion af glukagon stimuleres af:
- Hypoglykæmi
- Epinephrin (via β2-, α2- og α1-adrenerge receptorer)
- Arginin
- Alanin (ofte fra muskelafledt pyruvat / glutamattransaminering
- Acetylcholin
- Cholecystokinin
- Gastrisk hæmmende polypeptid
Sekretion af glukagon hæmmes af:
- Somatostatin
- Amylin
- Insulin (via GABA)
- PPARy / retinoid X-receptor heterodimer.
- Øgede frie fedtsyrer og ketosyrer i blodet.
- Øget urinstofproduktion
- Glukagon-lignende peptid-1
Glukagon struktur
Glucagon er et 29-aminosyre-polypeptid. Dens primære struktur hos mennesker er: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp -Leu-Met-Asn-Thr-COOH.
Polypeptidet har en molekylvægt på 3485 dalton. Glucagon er et peptid (ikke-steroid) hormon.
Glucagon genereres fra spaltningen af proglucagon af proprotein-convertase 2 i bugspytkirtelø-α-celler. I intestinale L-celler spaltes proglucagon til de alternative produkter glicentin, GLP-1 (et incretin), IP-2 og GLP-2 (fremmer tarmvækst).
Patologi
Unormalt forhøjede niveauer af glucagon kan være forårsaget af bugspytkirteltumorer, såsom glucagonoma, hvis symptomer inkluderer nekrolytisk vandrende erytem, reducerede aminosyrer og hyperglykæmi. Det kan forekomme alene eller i sammenhæng med multipel endokrin neoplasi type 1.
Forhøjet glukagon er den største bidragyder til hyperglykæmisk ketoacidose ved udiagnosticeret eller dårligt behandlet type 1-diabetes. Da betacellerne ophører med at fungere, er insulin og GABA i bugspytkirtlen ikke længere til stede for at undertrykke det fri løbende output af glucagon. Som et resultat frigives glukagon maksimalt fra alfa-cellerne, hvilket forårsager en hurtig nedbrydning af glykogen til glukose og hurtig ketogenese. Det blev fundet, at en delmængde af voksne med type 1-diabetes i gennemsnit tog 4 gange længere tid at nærme sig ketoacidose, når de fik somatostatin (hæmmer glukagonproduktion) uden insulin. Hæmning af glucagon har været en populær idé om diabetesbehandling, men nogle har advaret om, at dette vil give anledning til sprød diabetes hos patienter med tilstrækkelig stabil blodglukose.
Fraværet af alfaceller (og dermed glukagon) menes at være en af de vigtigste påvirkninger i den ekstreme volatilitet af blodglukose i forbindelse med en total pankreatektomi.
Historie
I 1920’erne studerede Kimball og Murlin bugspytkirtelekstrakter og fandt et ekstra stof med hyperglykæmiske egenskaber. De beskrev glucagon i 1923. Aminosyresekvensen for glucagon blev beskrevet i slutningen af 1950’erne. En mere komplet forståelse af dets rolle i fysiologi og sygdom blev først etableret i 1970’erne, hvor en specifik radioimmunanalyse blev udviklet.
.
















Discussion about this post