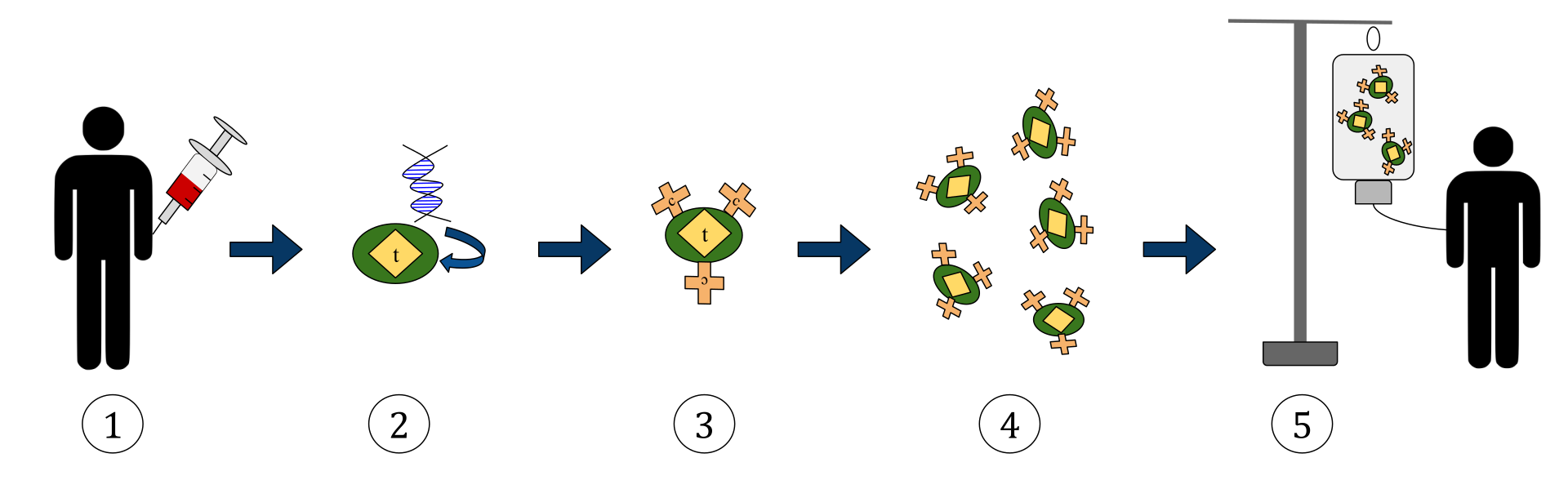
Diagrammet ovenfor repræsenterer processen med kimær antigenreceptor T-cellebehandling (CAR). Dette er en metode til immunterapi, som er en voksende praksis inden for behandling af kræft. Det endelige resultat skal være en produktion af udstyrede T-celler, der kan genkende og bekæmpe de inficerede kræftceller i kroppen.
1. T-celler (repræsenteret af genstande mærket som ‘t’) fjernes fra patientens blod.
2. Derefter inkorporeres genet, der koder for de specifikke antigenreceptorer, i et laboratorium i T-cellerne.
3. Dermed produceres CAR-receptorer (mærket som c) på overfladen af cellerne.
4. De nyligt modificerede T-celler høstes derefter og dyrkes i laboratoriet.
5. Efter en bestemt periode infunderes de konstruerede T-celler tilbage til patienten.
Kimære antigenreceptor-T-celler (også kendt som CAR T-celler) er T-celler, der er genetisk konstrueret til at producere en kunstig T-celle-receptor til anvendelse i immunterapi.
Kimære antigenreceptorer (BILER, også kendt som kimære immunreceptorer, kimære T-celle-receptorer, eller kunstige T-cellereceptorer) er receptorproteiner, der er konstrueret til at give T-celler den nye evne til at målrette mod et specifikt protein. Receptorerne er kimære, fordi de kombinerer både antigenbindende og T-celleaktiverende funktioner i en enkelt receptor.
CAR-T-celleterapi bruger T-celler konstrueret med CAR’er til kræftbehandling. Udgangspunktet for CAR-T immunterapi er at ændre T-celler til at genkende kræftceller for mere effektivt at målrette og ødelægge dem. Forskere høster T-celler fra mennesker, ændrer dem genetisk, og infunder derefter de resulterende CAR-T-celler i patienter for at angribe deres tumorer. CAR-T-celler kan enten stamme fra T-celler i en patients eget blod (autolog) eller stamme fra T-cellerne fra en anden sund donor (allogen). Når de er isoleret fra en person, er disse T-celler genetisk konstrueret til at udtrykke en bestemt CAR, som programmerer dem til at målrette mod et antigen, der er til stede på overfladen af tumorer. Af sikkerhedshensyn er CAR-T-celler konstrueret til at være specifikke for et antigen udtrykt på en tumor, der ikke udtrykkes på sunde celler.
Efter at CAR-T-celler er infunderet i en patient, fungerer de som et “levende lægemiddel” mod kræftceller. Når de kommer i kontakt med deres målrettede antigen på en celle, binder CAR-T-celler sig til det og bliver aktiveret, hvorefter de fortsætter med at sprede sig og blive cytotoksiske. CAR-T-celler ødelægger celler gennem flere mekanismer, herunder omfattende stimuleret celleproliferation, hvilket øger graden af, hvor de er giftige for andre levende celler (cytotoksicitet) og ved at forårsage den øgede sekretion af faktorer, der kan påvirke andre celler såsom cytokiner, interleukiner og vækstfaktorer.
Produktion af CAR-T-celler

Det første trin i produktionen af CAR-T-celler er isoleringen af T-celler fra humant blod. CAR-T-celler kan fremstilles enten fra patientens eget blod, kendt som en autolog behandling, eller fra blodet fra en sund donor, kendt som en allogen behandling. Fremstillingsprocessen er den samme i begge tilfælde; kun valget af indledende bloddonor er anderledes.
For det første isoleres leukocytter ved anvendelse af en blodcellseparator i en proces kendt som leukocytaferese. Perifere mononukleære blodceller (PBMC) separeres derefter og opsamles. Produkterne af leukocytaferese overføres derefter til et cellebehandlingscenter. I cellebehandlingscentret stimuleres specifikke T-celler, så de aktivt vil sprede sig og udvide sig til et stort antal. For at drive deres ekspansion behandles T-celler typisk med cytokin interleukin 2 (IL-2) og anti-CD3 antistoffer.
De ekspanderede T-celler oprenses og transduceres derefter med et gen, der koder for den konstruerede CAR via en retroviral vektor, typisk enten en integrerende gammaretrovirus (RV) eller en lentiviral (LV) vektor. Disse vektorer er meget sikre i moderne tid på grund af en delvis sletning af U3-regionen. Det nye genredigeringsværktøj CRISPR / Cas9 er for nylig blevet brugt i stedet for retrovirale vektorer til at integrere CAR-genet i specifikke steder i genomet.
Patienten gennemgår lymfeproduktionskemoterapi inden introduktionen af de konstruerede CAR-T-celler. Udtømningen af antallet af cirkulerende leukocytter i patienten opregulerer antallet af producerede cytokiner og reducerer konkurrencen om ressourcer, hvilket hjælper med at fremme udvidelsen af de konstruerede CAR-T-celler.
Kliniske anvendelser
Fra marts 2019 var der omkring 364 igangværende kliniske forsøg, der foregik globalt med CAR-T-celler. De fleste af disse forsøg er målrettet mod blodkræft: CAR-T-terapier tegner sig for mere end halvdelen af alle forsøg med hæmatologiske maligniteter. CD19 er fortsat det mest populære antigenmål, efterfulgt af BCMA (almindeligvis udtrykt i multipelt myelom). I 2016 begyndte undersøgelser at undersøge levedygtigheden af andre antigener, såsom CD20. Forsøg med faste tumorer er mindre domineret af CAR-T med ca. halvdelen af celleterapibaserede forsøg, der involverer andre platforme såsom NK-celler.
Kræft
T-celler er genetisk konstrueret til at udtrykke kimære antigenreceptorer, der specifikt er rettet mod antigener på en patients tumorceller og derefter infunderes i patienten, hvor de angriber og dræber kræftcellerne. Adoptiv overførsel af T-celler, der udtrykker CAR, er en lovende behandling mod kræft, CAR-modificerede T-celler kan konstrueres til at målrette næsten ethvert tumorassocieret antigen.
Tidlig CAR-T-celleforskning har fokuseret på blodkræft. De første godkendte behandlinger bruger biler, der er målrettet mod antigenet CD19, der er til stede i kræft afledt af B-celler, såsom akut lymfoblastisk leukæmi (ALL) og diffust stort B-celle lymfom (DLBCL). Der er også en igangværende indsats for at konstruere biler, der målretter mod mange andre blodkræftantigener, herunder CD30 i ildfast Hodgkins lymfom; CD33, CD123 og FLT3 i akut myeloid leukæmi (AML); og BCMA i myelomatose.
Solide tumorer har præsenteret et sværere mål. Identifikation af gode antigener har været udfordrende: sådanne antigener skal udtrykkes stærkt på de fleste kræftceller, men stort set fraværende i normalt væv. CAR-T-celler traffikeres heller ikke effektivt ind i centrum af faste tumormasser, og det fjendtlige tumormikromiljø undertrykker T-celleaktivitet.
Autoimmun sygdom
Mens de fleste CAR T-celleundersøgelser fokuserer på at skabe en CAR T-celle, der kan udrydde en bestemt cellepopulation (for eksempel CAR T-celler, der er målrettet mod lymfomceller), er der andre potentielle anvendelser for denne teknologi. T-celler kan også beskytte selvantigener mod autoimmune reaktioner. En regulerende T-celle udstyret med en CAR kunne have potentialet til at give tolerance over for et specifikt antigen, noget der kunne bruges i organtransplantation eller reumatiske sygdomme som lupus.
Satefy
Der er alvorlige bivirkninger, der skyldes, at CAR-T-celler introduceres i kroppen, herunder cytokinfrigivelsessyndrom og neurologisk toksicitet. Fordi det er en relativt ny behandling, er der kun få data om de langsigtede virkninger af CAR-T-cellebehandling. Der er stadig bekymringer over langvarig patients overlevelse såvel som graviditetskomplikationer hos kvindelige patienter behandlet med CAR-T-celler. Anafylaksi er en forventet bivirkning, da CAR er lavet med et fremmed monoklonalt antistof og som et resultat fremkalder et immunrespons.
On-target / off-tumor-genkendelse opstår, når CAR-T-cellen genkender det korrekte antigen, men antigenet udtrykkes på sundt, ikke-patogent væv. Dette resulterer i, at CAR-T-celler angriber ikke-tumorvæv, såsom sunde B-celler, der udtrykker CD19. Alvorligheden af denne bivirkning kan variere fra B-celle aplasi, som kan behandles med understøttende infusioner, til ekstrem toksicitet, der fører til døden.
Der er også den usandsynlige mulighed for, at de konstruerede CAR-T-celler selv vil blive transformeret til kræftceller gennem insertionsmutagenese på grund af den virale vektor, der indsætter CAR-genet i en tumorundertrykker eller onkogen i værts-T-celle genomet. Nogle retrovirale (RV) vektorer bærer en lavere risiko end lentivirale (LV) vektorer. Imidlertid har begge potentialet til at være onkogene. Genomisk sekventeringsanalyse af CAR-insertionssteder i T-celler er blevet etableret for bedre forståelse af CAR T-cellefunktion og persistens in vivo.
Cytokinfrigivelsessyndrom
Det mest almindelige problem efter behandling med CAR-T-celler er cytokinfrigivelsessyndrom (CRS), en tilstand, hvor immunsystemet aktiveres og frigiver et øget antal inflammatoriske cytokiner. Den kliniske manifestation af dette syndrom ligner sepsis med høj feber, træthed, myalgi, kvalme, kapillærlækager, takykardi og anden hjertedysfunktion, leversvigt og nedsat nyrefunktion. CRS forekommer hos næsten alle patienter behandlet med CAR-T-celleterapi; faktisk er tilstedeværelsen af CRS en diagnostisk markør, der indikerer, at CAR-T-cellerne fungerer som beregnet til at dræbe kræftcellerne. Bemærk dog, at en højere grad af CRS-sværhedsgrad ikke korrelerer med et øget respons på behandlingen, men snarere højere sygdomsbyrde.
Immuneffektorcelle-associeret neurotoksicitet
Neurologisk toksicitet er også ofte forbundet med CAR-T-cellebehandling. Den underliggende mekanisme er dårligt forstået og kan eller ikke er relateret til CRS. Kliniske manifestationer inkluderer delirium, delvis tab af evnen til at tale sammenhængende, mens man stadig har evnen til at fortolke sprog (udtryksfuld afasi), nedsat årvågenhed (obtundation) og krampeanfald. I nogle kliniske forsøg er der opstået dødsfald forårsaget af neurotoksicitet. Den vigtigste dødsårsag på grund af neurotoksicitet er hjerneødem. I en undersøgelse udført af Juno Therapeutics, Inc. døde fem patienter, der var indskrevet i forsøget, som et resultat af hjerneødem. To af patienterne blev behandlet med cyclophosphamid alene, og de resterende tre blev behandlet med en kombination af cyclophosphamid og fludarabin. I et andet klinisk forsøg sponsoreret af Fred Hutchinson Cancer Research Center var der et rapporteret tilfælde af irreversibel og dødelig neurologisk toksicitet 122 dage efter administration af CAR-T-celler.
.
















Discussion about this post